Anvisa aprovou, na reunião pública da Diretoria Colegiada desta terça-feira (19/3), uma instrução normativa que estabelece critérios para aproveitar avaliações de Autoridades Reguladoras Estrangeiras Equivalentes (AREEs) pela Agência.
A medida vale para as análises de registro e pós-registro de medicamentos, vacinas e produtos biológicos, incluindo a Carta de Adequação do Ingrediente Farmacêutico Ativo (Cadifa). Também conhecida como reliance (confiança regulatória), a norma estabelece um processo simplificado para produtos que tenham sido aprovadas por reguladores estrangeiros com regulamentos e práticas equivalentes aos da Anvisa.
As AREEs contempladas pela medida são:
I – Agência Europeia de Medicamentos – European Medicines Agency (EMA).
II – Agência Canadense de Saúde – Health Canada.
III – Organização Mundial da Saúde – OMS.
IV – Direção Europeia da Qualidade dos Medicamentos e Cuidados de Saúde – European Directorate for the Quality of Medicines & HealthCare (EDQM).
V – Agência Suíça de Produtos Terapêuticos – Swissmedic.
VI – Agência Reguladora de Medicamentos e Produtos de Saúde – Medicines and Healthcare products Regulatory Agency (MHRA) – Reino Unido.
VII – Agência Reguladora dos Estados Unidos – US Food and Drug Administration (FDA).
VIII – Therapeutic Goods Administration (TGA) – Austrália.
Princípios para uso da via de reliance
Os critérios estabelecidos na instrução normativa são fundamentados em princípios que visam assegurar a integridade e a eficácia dos processos regulatórios.
Isso inclui a submissão completa dos documentos requeridos, a conformidade com a legislação brasileira vigente e a demonstração de equivalência entre produtos aprovados por autoridades regulatórias estrangeiras de referência e aqueles submetidos à avaliação da Anvisa.
Entenda o processo que embasou a aprovação
Este avanço regulatório foi resultado de um processo cuidadosamente planejado e executado em etapas distintas.
Inicialmente, com a aprovação da RDC 750/2022, uma fase-piloto foi conduzida, a partir de agosto de 2022, com o objetivo de testar e avaliar a viabilidade do novo modelo, além de coletar informações e experiências relevantes.
Em seguida, a Consulta Pública 1.108, realizada entre 15 de outubro e 29 de dezembro de 2022, permitiu a participação e a contribuição das partes interessadas para aprimorar os critérios propostos. As informações obtidas durante essas fases foram analisadas e consolidadas para refinar o texto normativo, culminando na sua aprovação para implementação em 2024.
Ao longo do processo, a Anvisa promoveu uma série de atividades de interação com as partes interessadas, incluindo reuniões públicas, a publicação de documentos técnicos explicativos e o esclarecimento de dúvidas de todos os interessados. Além disso, a Agência também estabeleceu diálogos bilaterais com diversas autoridades reguladoras estrangeiras, com o intuito de compartilhar experiências e boas práticas.
Resultados
Os resultados obtidos durante a fase-piloto demonstraram um interesse significativo por parte das empresas, com um considerável número de pedidos de registro e pós-registro de medicamentos, produtos biológicos e de pedidos de regularização de insumos farmacêuticos ativos.
No período de setembro de 2022 a fevereiro de 2024, foram submetidos 408 dossiês de registro e alteração de registro de medicamentos biológicos, sintéticos e semissintéticos, além de dossiês de Cadifas, pela via de reliance. Desses 408 dossiês, 211 foram aprovados e 178 dossiês ainda aguardam avaliação, conforme a tabela abaixo:
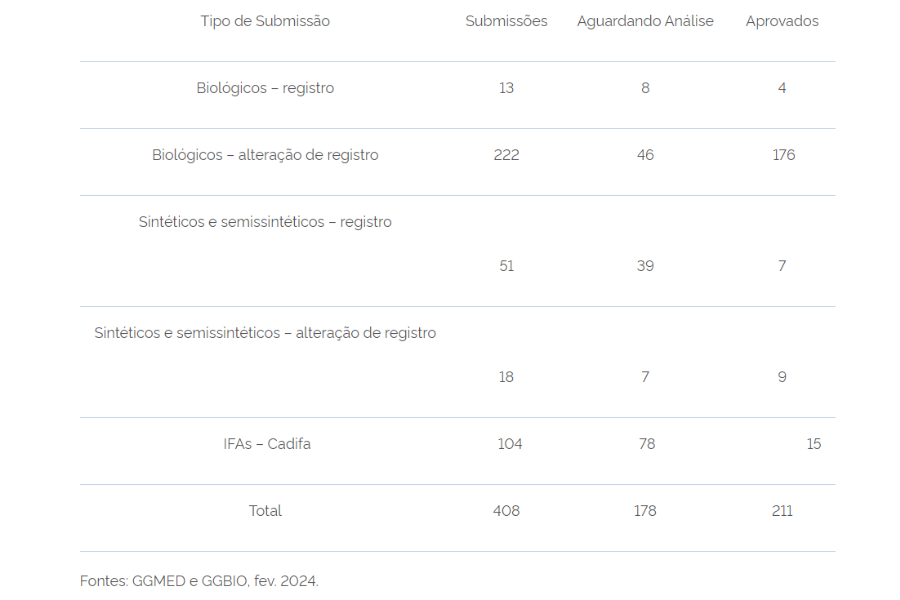
Esse cenário reflete a importância e a relevância das mudanças implementadas para o setor regulado.
Futuro
A Anvisa e outras autoridades reguladoras têm buscado fortalecer a cooperação internacional e a troca de informações, bem como estabelecer mecanismos que promovam a interoperabilidade e a padronização de processos. Tais iniciativas têm como objetivo maximizar os benefícios para os pacientes e garantir a segurança e a eficácia dos produtos regulados pelas agências de saúde em todo o mundo.
Referências:
ANVISA: https://www.gov.br/anvisa