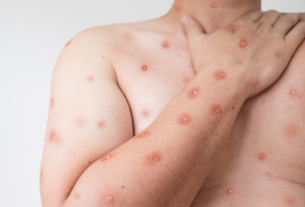
Casos de reações de hipersensibilidade têm sido relatados com uma frequência acima do esperado, no entanto, a ocorrência desses eventos continua rara. Todos os casos foram tratados, e os pacientes se recuperaram.
A detentora do registro confirmou um caso de hipersensibilidade e comunicou à Anvisa, que, como rotina da farmacovigilância, solicitou a inclusão deste evento na bula do produto.
Como medida de prevenção e precaução, o Ministério da Saúde reforça a recomendação usual da prática segura de observação dos indivíduos vacinados por 15 minutos após a vacinação. Ainda, no contexto da reduzida quantidade de doses disponibilizadas, orienta-se que a vacinação da Qdenga se dê em unidades de saúde. Os serviços de saúde devem tomar medidas para pronta identificação dos eventos e prestação de assistência adequada.
Farmacovigilância
Nenhum medicamento ou vacina é isento de risco. Para que seja possível ampliar o conhecimento sobre a segurança de um dado produto, todo novo medicamento ou vacina está submetido ao processo de monitoramento pós-mercado, ou seja, quando o produto é utilizado na vida real, e podem ser observados eventos adversos não identificados na fase dos estudos clínicos.
A identificação precoce de eventos adversos reflete uma farmacovigilância eficiente, pois quanto antes detectado um sinal de segurança, mais oportunas e efetivas são as medidas adotadas para prevenir a ocorrência dos eventos.
Confira a nota do Ministério da Saúde.
Referências:
ANVISA: https://www.gov.br/anvisa