A Anvisa recebeu 28.147 notificações de eventos adversos a vacinas e medicamentos no primeiro semestre de 2023.
Esses dados foram publicados pela Agência na nova edição do Boletim Informativo de Monitoramento Pós-Mercado referente ao primeiro semestre de 2023. Essa edição traz os destaques das diversas áreas de monitoramento de produtos da Anvisa como Nutrivigilância, Biovigilância, Cosmetovigilância, Tecnovigilância, Farmacovigilância, Hemovigilância e Vigilância de Saneantes.
Uma das áreas de destaque foi a Farmacovigilância que após análises, excluindo-se as notificações incompletas ou relativas a estudos clínicos, resultou um total de 27.357 notificações que foram encaminhadas para base de Farmacovigilância da Organização Mundial de Saúde/OMS, a VigiBase.
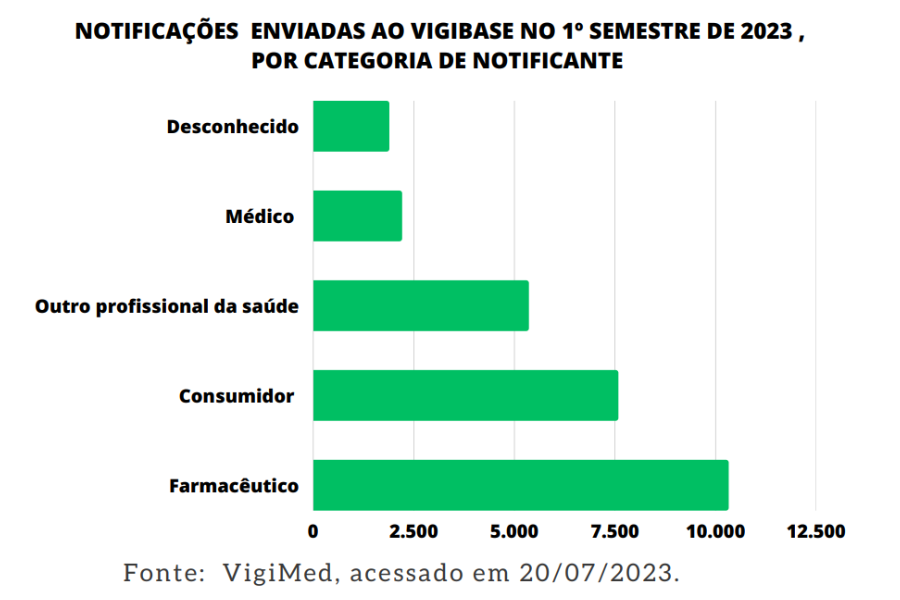
Do total de notificações enviadas para a base VigiBase nesse período, as categorias que mais notificaram foram:
- Farmacêutico (37,7%, n = 10.318),
- Consumidor / Não-Profissional de Saúde (27,7%, n = 7.576)
- Outro Profissional de Saúde (19,6%, n = 5.352)
- Na categoria Médico, consta 2.201 notificações (8%)
- Desconhecido 1.883 (6,9%)
Relatórios Periódicos De Avaliação Benefício-Risco (RPBR) E Planos De Gerenciamento De Risco (PGR)
De acordo com o relatório, a partir do ano de 2021 todas as empresas responsáveis pela fabricação de produtos contendo um mesmo princípio ativo estão obrigadas a apresentar os seus relatórios RPBR (Relatórios Periódicos de Benefício-Risco). Essa medida visa a proporcionar análises mais abrangentes e robustas sobre o perfil de segurança de um fármaco em um período de tempo reduzido.
A integração desses conjuntos de dados e informações, juntamente com a colaboração de especialistas e instituições internacionais, agiliza a emissão de alterações em bulas, alertas e comunicados sobre riscos.
Ao longo do primeiro semestre de 2023, um total de 1.050 Relatórios Periódicos de Avaliação Benefício-Risco foram submetidos à Anvisa. Adicionalmente, foram recebidos 179 Planos de Gerenciamento de Risco. Esse documento é apresentado pelas empresas no momento de submissão dos dossiês para o registro de medicamentos e vacinas.
Esses planos detalham as ações de Farmacovigilância de rotina, ao mesmo tempo em que contemplam medidas adicionais propostas para mitigar os riscos associados a cada medicamento. Esse conjunto de medidas busca promover uma abordagem abrangente e cuidadosa no monitoramento e gerenciamento de riscos ligados ao uso de produtos farmacêuticos.
Comunicados aos profissionais de saúde
Segundo a Anvisa, no primeiro semestre de 2023, foi divulgada no portal da Agência uma “Carta aos Profissionais da Saúde” referente à alteração de formulação do medicamento Purinethol® – Mercaptopurina 50 mg comprimido, registrado pela Aspen Pharma. A Agência não reportou a existência de outros comunicados para profissionais da saúde que fossem relevantes do ponto de vista da Farmacovigilância.
Referências:
ANVISA: https://www.gov.br/anvisa





