O artigo de Hitesh Chavda publicado no periódico Drug Development and Industrial Pharmacy, explora as diretrizes e desafios relacionados aos estudos de estabilidade em uso, com foco especial nos produtos farmacêuticos embalados em recipientes multidose.
Enquanto diretrizes formais de estabilidade já estão estabelecidas para produtos em dose única ou unitária, é nos produtos em recipientes multidose que as complexidades da estabilidade em uso ganham destaque. Isso ocorre devido à possibilidade de riscos associados à contaminação após a primeira abertura, reconstituição ou diluição. A abordagem desses riscos é crucial para manter a qualidade dos produtos durante todo o período de uso.
Importância e Relevância da Estabilidade em Uso
A estabilidade em uso é de vital importância para garantir que produtos farmacêuticos permaneçam seguros, eficazes e dentro dos padrões de qualidade estabelecidos desde o momento da primeira abertura até o término do período de uso.
Esses estudos simulam as condições reais de uso, proporcionando uma compreensão completa das possíveis alterações físicas, químicas e microbiológicas que podem ocorrer ao longo do tempo. Essas informações são cruciais para garantir a segurança dos pacientes e a eficácia dos tratamentos.
Tabela 1: Exemplo de parâmetros que são avaliados durante um estudo de estabilidade em uso.
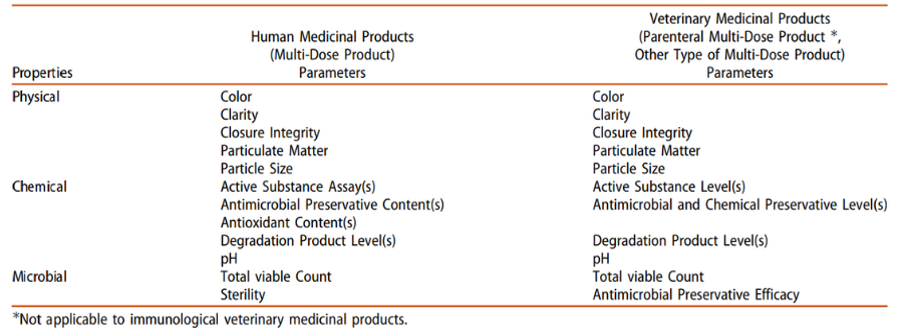
Fonte: Chavda, H., Drug Development and Industrial Pharmacy.
Diretrizes e Orientações
Organizações internacionais, como a Organização Mundial da Saúde (OMS) e a Conferência Internacional de Harmonização (ICH), emitiram diretrizes detalhadas sobre estudos de estabilidade em uso.
O documento da OMS, intitulado Série de Relatórios Técnicos No. 1010, fornece um guia abrangente para a realização desses estudos. A OMS recomenda um período de estabilidade em uso de 30 dias, mas também ressalta a importância de projetar estudos que simulem o uso real do produto, considerando fatores como o volume de enchimento do recipiente e quaisquer etapas de diluição ou reconstituição.
O ICH também contribui com suas orientações, enfatizando a necessidade de avaliar a compatibilidade do produto com diluentes de reconstituição. Além disso, as diretrizes da Agência Europeia de Medicamentos (EMA) abordam a estabilidade em uso de produtos medicinais humanos e veterinários, bem como produtos estéreis após a primeira abertura ou reconstituição.
Tabela 2: Exemplo de plano de amostragem para formulação oral líquida.

Fonte: Chavda, H., Drug Development and Industrial Pharmacy.
Tabela 3: Exemplo de plano de teste para formulação oral líquida.

Fonte: Chavda, H., Drug Development and Industrial Pharmacy.
Desafios e Complexidades
O artigo destaca os desafios associados aos estudos de estabilidade em uso, incluindo produtos tópicos, produtos injetáveis, produtos diluídos ou reconstituídos, e produtos com administração prolongada. A fotodegradação em uso também é abordada como um desafio, especialmente para produtos tópicos e injetáveis. A complexidade das proteínas biológicas adiciona uma camada adicional de desafio aos estudos de estabilidade em uso devido a suas características únicas.
Modelagem de Estabilidade em Uso
O artigo explora modelos de estabilidade em uso, como aquele que avalia a absorção de umidade em comprimidos e pós em frascos. Além disso, um modelo estatístico é apresentado para prever a degradação de produtos em uso aberto ou fechado, considerando variáveis como troca de ar e adsorção de umidade. Esses modelos têm como objetivo fornecer uma visão mais precisa dos fatores que afetam a estabilidade em uso.
Conclusão
O artigo conclui destacando a importância contínua da estabilidade em uso na indústria farmacêutica e enfatizando a necessidade de diretrizes atualizadas e abrangentes. A ausência de orientações específicas e informações limitadas podem representar um ônus para a indústria e dificultar a realização eficaz de estudos de estabilidade em uso. A busca por soluções para esses desafios é crucial para garantir a qualidade, eficácia e segurança dos produtos farmacêuticos durante seu uso real.
Referências: